Отношение массы растворенного вещества к массе раствора

1) Массовая доля (ω) – отношение массы растворенного вещества к массе раствора
Для производства синтетических материалов, растворов и смесей важно знать не только из чего они состоят, но в каком количестве должен быть добавлен каждый компонент. Если говорить языком химии, нужно знать массовую долю веществ в смеси. Сейчас мы узнаем, что она собой представляет и как ее находить. Начнем с примера: допустим, мы приготовили два раствора соли. Первый имеет массу г и для него использовано г соли. Масса второго г и для него использовали 90 г соли.





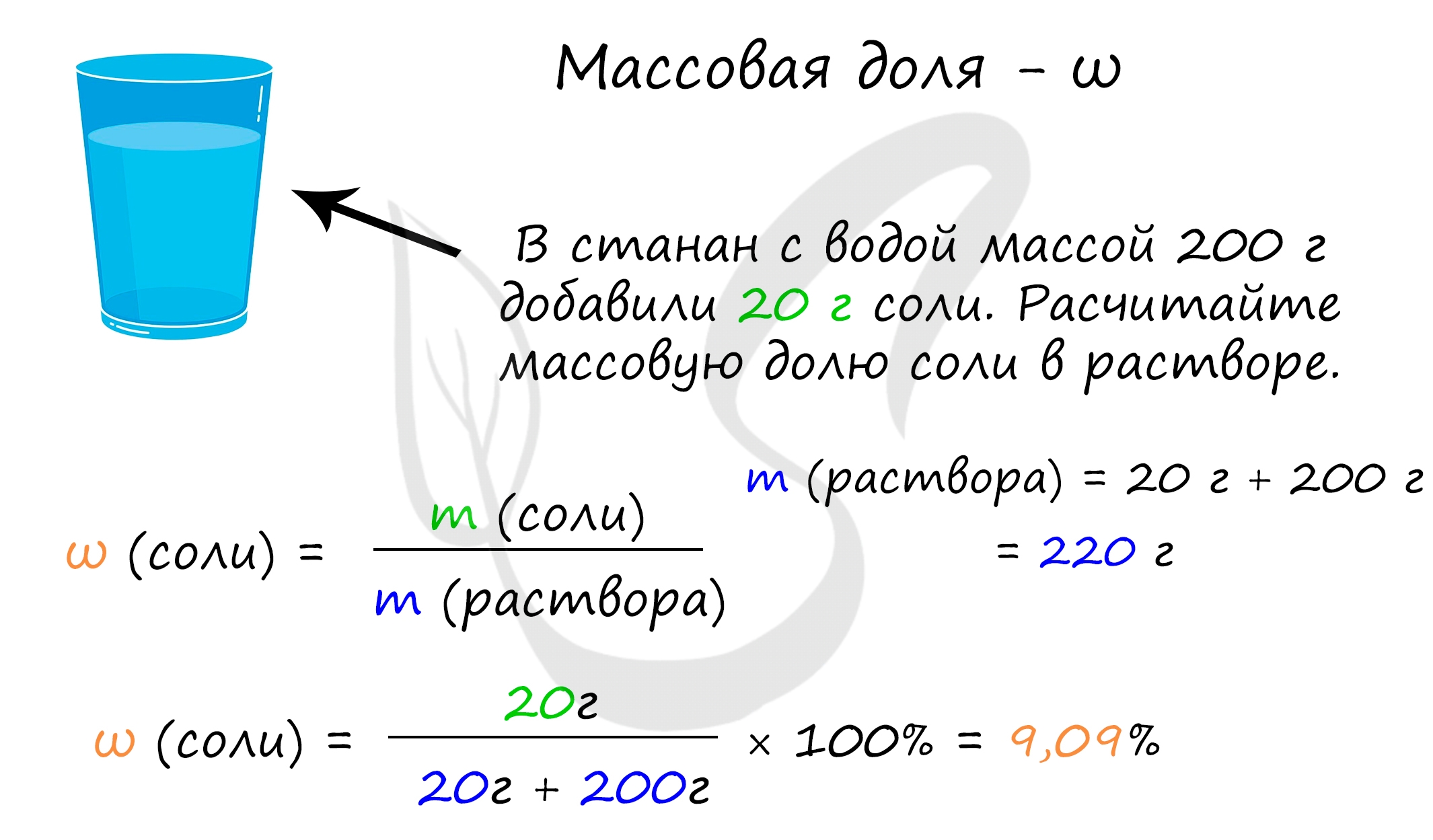

Массовая доля растворенного вещества — это отношение массы растворенного вещества к общей массе раствора. Она показывает сколько вещества содержится в растворе. Главная Калькуляторы по химии Массовая доля растворенного вещества Массовая доля растворенного вещества Массовая доля растворенного вещества — это отношение массы растворенного вещества к общей массе раствора. Массовая доля, выраженная в процентах, рассчитывается по формуле: Онлайн калькулятор массовой доли растворенного вещества позволяет определить процентную концентрацию вещества в растворе. Масса вещества, г. Масса раствора, г.
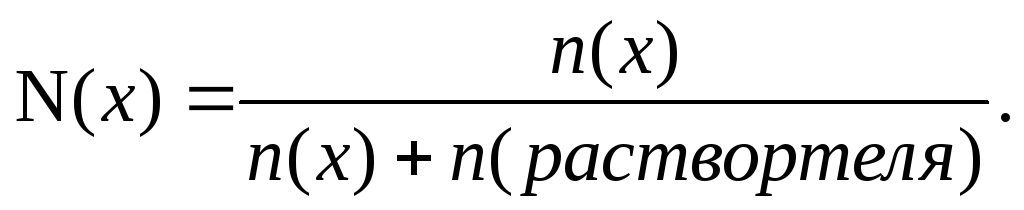


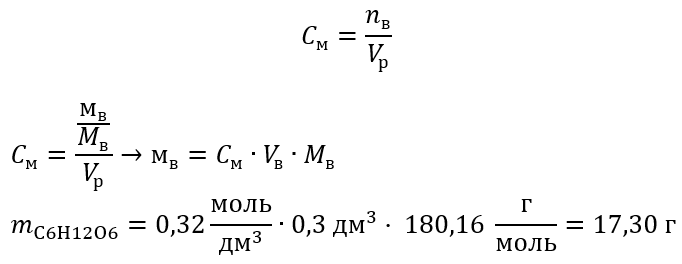
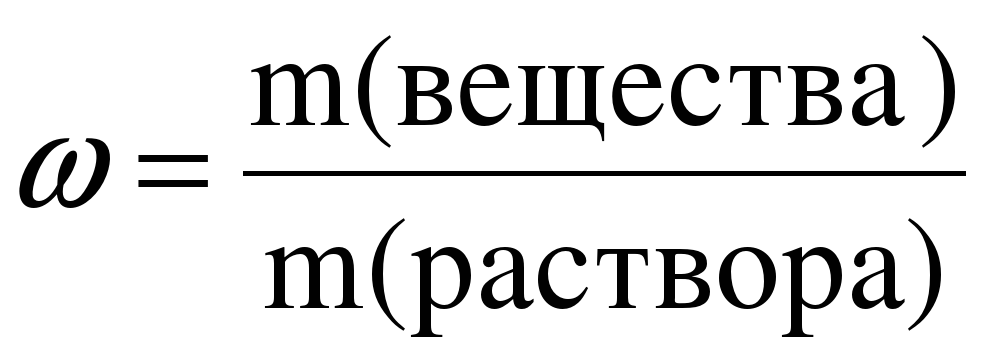



Существуют различные способы выражения состава раствора. Наиболее часто используют массовую долю растворённого вещества, молярную и нормальную концентрацию. Это означает, что в растворе хлорида кальция массой г содержится хлорид кальция массой 6 г и вода массой 94 г. Молярная концентрация c B показывает, сколько моль растворённого вещества содержится в 1 литре раствора:. Например, 2 M NaOH — двухмолярный раствор гидроксида натрия.






